与疾病发生发展密切相关的低丰度生物标志物的超灵敏、多指标检测是生物医学领域的重大需求,但目前常用的检测技术往往无法在单管检测中同时实现多重生物标志物的精准鉴别和高灵敏检测。新兴的基于隔离分区模式的数字式生物检测平台虽能达到超高的检测灵敏度,但受限于荧光检测通道的数量与鉴别目标分子的编码方式,无论是核酸样本还是蛋白样本,单管反应中检测的目标分子种类均不超过10重。因此,如何在单管多重指标鉴别的同时实现超高灵敏检测是目前生物检测领域中极具挑战的瓶颈问题。
据麦姆斯咨询报道,针对上述亟待突破的关键问题,上海交通大学生物医学工程学院古宏晨/徐宏团队聚焦可快速生成无限量分区的高通量液滴微流控平台,采用团队独创的编码微球载体,构建了新型“编码微球-液滴”基微流控芯片,并在此基础上发展了“蛋白-核酸”通用型超灵敏数字式生物检测技术。创新地实现了:(1)单个液滴对单个编码微球的装载率突破传统“泊松分布”的限制,极大提高了数字式生物检测的分析效率与检测通量;(2)多重蛋白和核酸分子在编码微球载体表面的单分子高效捕获、“单微球-单分子”待检编码信号的准确鉴别、单分子靶标信号放大与单分子检测。
高效单编码微球封装的液滴微流控系统
在传统的液滴分区中,利用荧光编码微球作为鉴别、捕获靶分子的载体,虽可大幅提高检测重数与通量,但受限于泊松分布,液滴分区对单个微球的封装完全随机,通常仅有10%以下的分区为含有1个编码微球的有效液滴,90%的液滴为未封装编码微球的空液滴。这些冗余的空液滴会在后续的检测分析中造成分析资源的大量浪费。因此,基于“编码微球-液滴”的多重数字式检测方法学需要解决的首要问题是如何突破泊松分布的限制,让有且仅有一个编码微球的液滴分区比例大幅提高。针对此问题,该团队提出了一种集微球排列、液滴生成与微球包裹的集成式“编码微球-液滴”微流控芯片(bead ordered arrangement droplet system,BOAD)系统。首先利用巧妙的流体结构设计,在短至1cm的微流道中实现微球的快速有序排列,进而将有序排列的微球一一封装入液滴。研究结果显示,BOAD系统可将包裹有单个编码微球的液滴分区比例大幅提升至86%,单个微球的封装效率是常规检测体系的9倍。进一步地,该研究还展示了54重编码微球的高效包裹与精准解码。最后,采用IL-10为模式待测分子,证明了构建的BOAD系统可实现超灵敏的数字式检测,检测灵敏度较传统流式免疫荧光提高500倍。上述结果均展示了BOAD系统在多重数字式超敏检测与单细胞分析等领域的强大应用潜力。
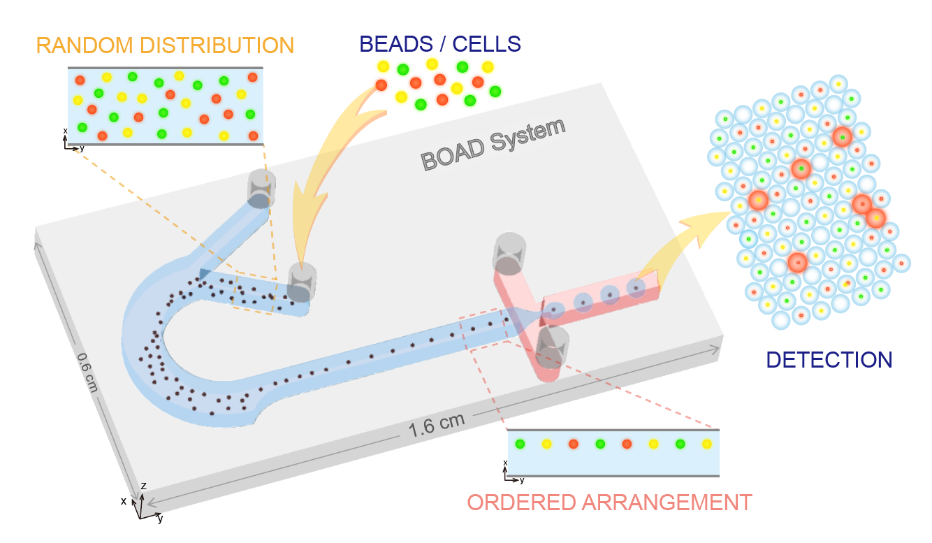
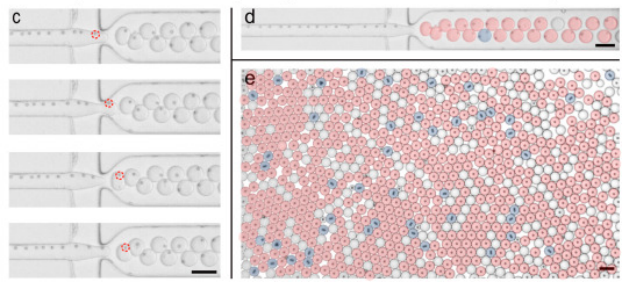
图1 课题组提出的高效单微球封装的液滴微流控系统
“编码微球-液滴”基多重数字ELISA超敏检测系统
灵敏度到亚fM级别(fg/mL)的超灵敏、多重数字酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)检测技术在基础生命科学研究和临床应用等方面(如肿瘤早筛、阿尔兹海默病血液基标志物的检测等)都具有重要的意义。该团队基于液滴微流控平台,以自主设计开发的新型荧光编码微球作为识别不同蛋白分子的载体,创新性地开发了一种兼具通用性与实用性的多重数字ELISA技术。首先,针对如何在直径几十微米的pL级液滴中实现直径仅几微米的编码微球精准解码难题,团队提出采用短、长曝光时间的二次成像方法,显著提高编码微球在液滴中的解码精度,为超高重蛋白分子的多重数字式检测提供可靠的检测平台。其次,针对pL液滴的单分子信号准确、快速检出问题,采用酶信号放大单元作为酶标记物,快速实现单个待测分子的信号放大,仅需5min即可实现“1”和“0”液滴的区分与准确计数,显著缩短检测时间。最后,以TNF-α、IL-6、IFN-γ、IL-17A、IL-10等5种细胞因子为模式待测分子,在构建的“编码微球-液滴”微流控芯片上成功实现了单管多重蛋白的数字式检测,检测灵敏度较传统的多重悬浮芯片技术提升了100+~10000+倍。该工作证明了“编码微球-液滴”基微流控技术有望成为临床超敏蛋白检测新的解决方案。
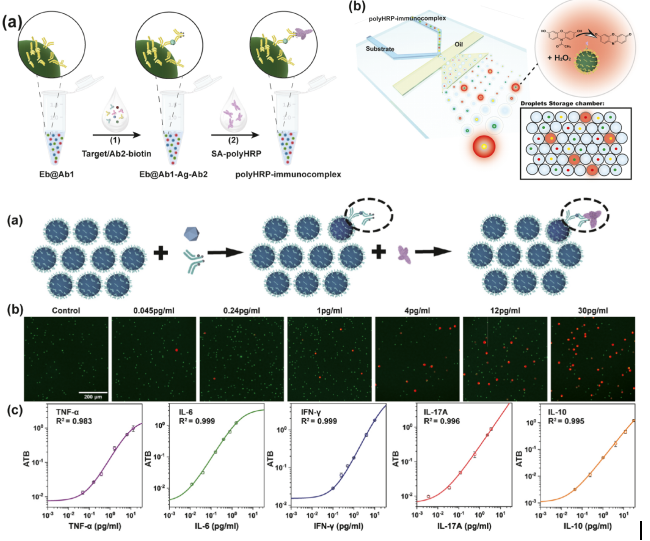
图2 “编码微球-液滴”基多重数字ELISA超敏检测系统
“编码微球-液滴”基多重数字PCR检测系统
多重数字聚合酶链式反应(polymerase chain reaction,PCR)受到临床应用与基础生命科学研究等领域的日益关注。然而,当前的多重数字PCR技术缺乏兼具高灵敏度、高信噪比和超高多重靶标同时检测的有效策略。基于此,该团队提出了一种基于荧光编码微球的液滴基多重数字PCR超敏检测方法(Bead-based multiplexed droplet digital PCR)。该方法采用团队自主研发的超高编码容量荧光编码微球作为不同核酸的鉴别载体,从而大幅提升检测重数;进而结合通用引物与通用探针序列的巧妙设计,在“编码微球-液滴”微流控平台上实现高信噪比、超灵敏的多重核酸检测。在该方法中,以新型冠状病毒相关的orf1ab和N基因、甲型流感、乙型流感各自保守区基因以及阳控质粒作为模式待测靶标,通过预富集在不同靶基因上分别引入完全相同的通用序列;再利用固定有特异性探针的荧光编码微球,对富集后的不同核酸分子进行单分子特异性捕获,形成“单个编码微球-单个核酸分子”杂交复合物;最后,将上述微球杂交复合物包裹进含有通用扩增引物和通用荧光水解探针的液滴中,进行单反应多重数字PCR检测。该方法在流感病毒和新型冠状病毒的五重联检中可实现接近单分子级别的检测灵敏度,信噪比高且无交叉反应,为超高重数和超灵敏度的多重数字PCR技术奠定了基础,具有实际临床应用的潜力。
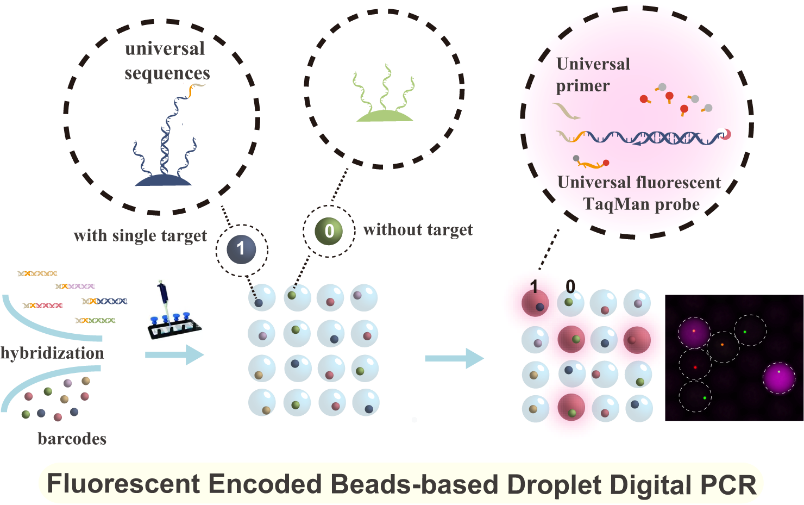
图3 “编码微球-液滴”基多重数字PCR检测系统
-
封装
+关注
关注
128文章
8364浏览量
144498 -
编码
+关注
关注
6文章
965浏览量
55366 -
微流控系统
+关注
关注
1文章
85浏览量
1975
原文标题:基于“编码微球-液滴”的微流控芯片,实现多重超灵敏数字式检测
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
用于微液滴的连续流动洗涤微流控系统
硬件原理图学习笔记
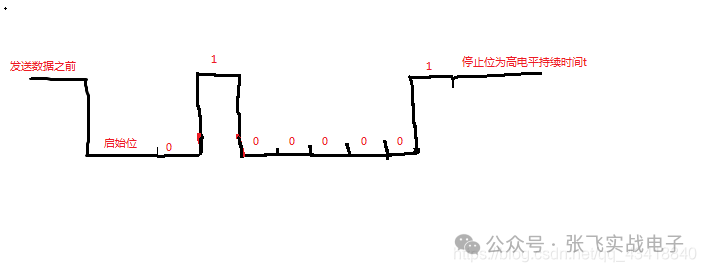
这一个星期认真学习了硬件原理图的知识,做了一些笔记,方便以后查找。硬件原理图分为三类1.管脚类(gpio)和门电路类输入输出引脚,上拉电阻,三极管与门,或门,非门上拉电阻:正向标志作用,给悬空的引脚一个确定的状态三极管:反向三极管(gpio输出高电平,NP两端导通,被控制端导通,电压为0)->NPN正向三极管(gpio输出低电平,PN两端导通,被控制端导通,

TurMass™ vs LoRa:无线通讯模块的革命性突破
TurMass™凭借其高传输速率、强大并发能力、双向传输、超强抗干扰能力、超远传输距离、全国产技术、灵活组网方案以及便捷开发等八大优势,在无线通讯领域展现出强大的竞争力。

RZT2H CR52双核BOOT流程和例程代码分析
RZT2H是多核处理器,启动时,需要一个“主核”先启动,然后主核根据规则,加载和启动其他内核。本文以T2H内部的CR52双核为例,说明T2H多核启动流程。

干簧继电器在RF信号衰减中的应用与优势
在电子测试领域,RF(射频)评估是不可或缺的一部分。无论是研发阶段的性能测试,还是生产环节的质量检测,RF测试设备都扮演着关键角色。然而,要实现精准的RF评估,测试设备需要一种特殊的电路——衰减电路。这些电路的作用是调整RF信号的强度,以便测试设备能够准确地评估RF组件和RF电路的各个方面。衰减器的挑战衰减器的核心功能是校准RF信号的强度。为了实现这一点,衰

ElfBoard嵌入式教育科普|ADC接口全面解析
当代信息技术体系中,嵌入式系统接口作为数据交互的核心基础设施,构成了设备互联的神经中枢。基于标准化通信协议与接口规范的技术架构,实现了异构设备间的高效数据交换与智能化协同作业。本文选取模数转换接口ADC作为技术解析切入点,通过系统阐释其工作机理、性能特征及重要参数,为嵌入式学习者爱好者构建全维度接口技术认知框架。

深入理解C语言:C语言循环控制
在C语言编程中,循环结构是至关重要的,它可以让程序重复执行特定的代码块,从而提高编程效率。然而,为了避免程序进入无限循环,C语言提供了多种循环控制语句,如break、continue和goto,用于改变程序的执行流程,使代码更加灵活和可控。本文将详细介绍这些语句的作用及其应用场景,并通过示例代码进行说明。Part.1break语句C语言中break语句有两种

第 21 届(顺德)家电电源与智能控制技术研讨会圆满落幕--其利天下斩获颇丰
2025年4月25日,其利天下应大比特之邀出席第21届(顺德)家电电源与智能控制技术研讨会,已圆满落幕。一、演讲回顾我司研发总监冯建武先生在研讨会上发表了主题为《重新定义风扇驱动:一套算法兼容百种电机的有效磁链观测器方案》的演讲,介绍了我司研发自适应技术算法(简称),该方案搭载有效磁链观测器,适配百种电机类型,结合FOC算法可实现免调参稳定启动、低速静音控制

来自资深工程师对ELF 2开发板的产品测评
来自资深工程师对ELF 2开发板的使用测评

飞凌嵌入式2025嵌入式及边缘AI技术论坛圆满结束
飞凌嵌入式「2025嵌入式及边缘AI技术论坛」在深圳深铁皇冠假日酒店盛大举行,此次活动邀请到了200余位嵌入式技术领域的技术专家、企业代表和工程师用户,共享嵌入式及边缘AI技术的盛宴!
常用运放电路总结记录
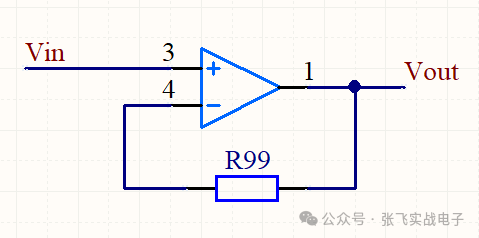
一、电压跟随器电压跟随器,电路图如下:电路分析:(本文所有的运放电路分析,V+表示运放同向输入端的电压,V-表示反向输入端的电压。)1.1电压跟随器反馈电阻需不需要?在上面的电压跟随器示例中,我画上了一个反馈电阻R99,大家在学习的运放的时候,可能很多地方也会提一下这个反馈电阻,很多地方会说可加可不加,效果一样。电阻需不需要加:但是本文这里个人建议使用电压跟
运放-运算放大器经典应用电路大全-应用电路大全-20种经典电路
20种运放典型电路总结,电路图+公式1、运放的符号表示2、集成运算放大器的技术指标(1)开环差模电压放大倍数(开环增益)大Ao(Ad)=Vo/(V±V-)=107-1012倍;(2)共模抑制比高KCMRR=100db以上;(3)输入电阻大ri>1MW,有的可达100MW以上;(4)输出电阻小ro=几W-几十W3、集成运放分析方法(V+=V-虚短,ib-=ib

RDK X3新玩法:超沉浸下棋机器人开发日记
一、项目介绍产品中文名:超沉浸式智能移动下棋机器人产品英文名:Hackathon-TTT产品概念:本项目研发的下棋机器人,是一款能自主移动、具备语音交互并能和玩家在真实的棋盘上进行“人机博弈”的移动下棋平台,能够带给对弈者如同真人对弈的完美沉浸式体验——棋开得胜团队。该智能下棋机器人具备3个显著优点:真实棋盘棋子对弈:通过使用真实棋子、棋盘和机械臂,给对弈者

芯对话 | 微处理器监控电路革新:CBM70X系列 重构系统可靠性
总述在工业自动化、消费电子、汽车电子等领域,微处理器作为系统核心,其稳定运行依赖可靠的电源监控。据统计,65%的系统故障源于电源异常——工业控制设备因电压波动导致的停机频率每月平均达3.2次,便携式设备因电池管理不当造成的续航缩水普遍超过25%,汽车电子ECU因电源扰动引发的误判率在复杂工况下高达18%。传统监控方案的三大核心痛点极端电压适应性不足:当电压低

喜讯!米尔电子与安路科技达成IDH生态战略合作,共筑FPGA创新生态
以芯为基,智创未来。近日,领先的嵌入式模组厂商-米尔电子正式与国产FPGA企业安路科技达成IDH生态战略合作。双方将围绕安路科技飞龙SALDRAGON系列高性能FPSoC,联合开发核心板、开发板及行业解决方案,助力开发者开发成功,加速工业控制、边缘智能、汽车电子等领域的创新应用落地。米尔电子&安路科技IDH生态合作证书硬核技术+生态协同安路科技作为
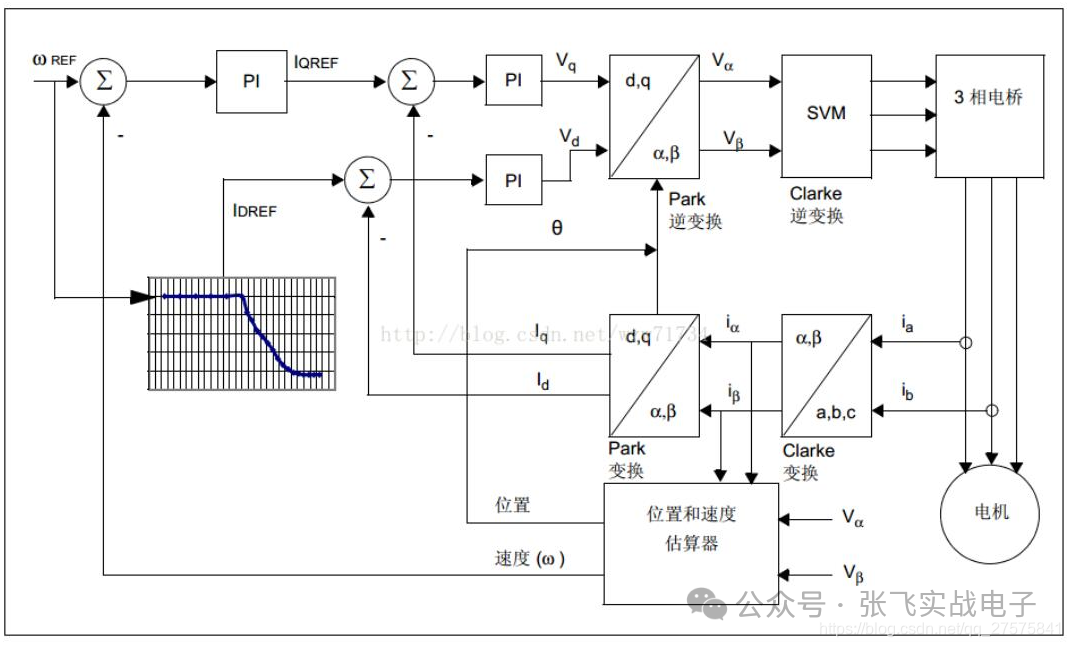
FOC控制算法详解
一、基本概念:FOC(field-orientedcontrol)为磁场导向控制,又称为矢量控制(vectorcontrol),是一种利用变频器(VFD)控制三相电机的技术,利用调整变频器的输出频率、输出电压的大小及角度,来控制电机的输出。由于处理时会将三相输出电流及电压以矢量来表示,因此称为矢量控制。二、控制原理:FOC控制的其实是电机的电磁场方向。转子的





 基于高效单编码微球封装的液滴微流控系统
基于高效单编码微球封装的液滴微流控系统













评论