组织工程具有开发体外器官模型系统的巨大潜力。随着2000年代后期开始的小型化趋势,三维(3D)微组织模型已被用于研究受损纤维组织的修复、心肌和肺组织的形成和成熟等组织生物学的基本特征。此外,由于具有较高的空间和时间分辨率,光遗传学已成为时空控制细胞信号转导的强大工具。
目前,通过对RhoA活性进行光遗传学控制,已有一些研究可以使用光脉冲来局部上调或下调细胞产生的力。Valon等人的进一步研究证明,细胞张力的变化与二维上皮单层中的组织变形有关,表明细胞具有作为机械执行器的潜力。这种生物执行器可用于使用光诱导的生理机械刺激来探测组织力学。
据麦姆斯咨询报道,近期,法国格勒诺布尔-阿尔卑斯大学(University Grenoble Alpes)的研究人员结合组织工程和光遗传学技术,设计了由封装在胶原蛋白中的光基因修饰的成纤维细胞组成的微组织,并通过利用光来控制调节细胞收缩性的主要因子——RhoA的活性,成功在微组织内诱导了局部收缩,并实现了对微组织应力和应变的监测。相关研究成果以“Light-driven biological actuators to probe the rheology of 3D microtissues”为题,发表于Nature Communications期刊。
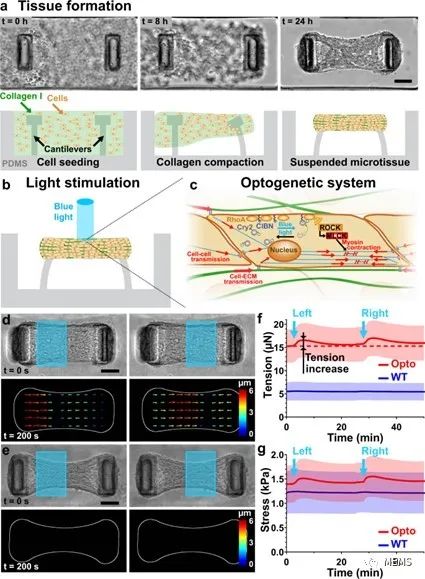
图1 微组织的光控收缩
基于所提出的组织工程耦合光遗传学的方法,该研究实现了对微组织特定部分应力的时空控制和测量,并通过粒子图像测速仪(PIV)进一步实现了对组织应变的推断。此外,研究人员对微组织的流变性进行了探索,并证明了所提出的方法在量化悬臂刚度、细胞外基质(ECM)以及成纤维细胞向肌成纤维细胞的分化对组织弹性的影响方面的潜力。最后,该研究展示了所提出的方法在机械异质性微组织中测定局部各向异性,以及在组织形成过程中使用重复刺激影响组织结构的能力。
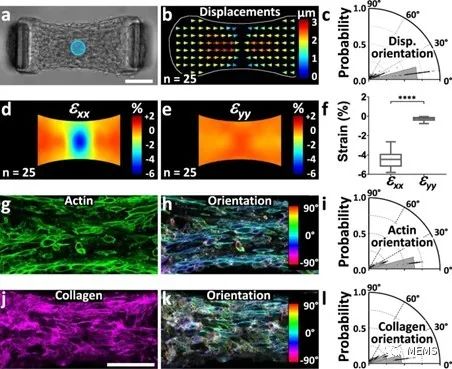
图2 光遗传学诱导收缩的各向异性与微组织结构相关
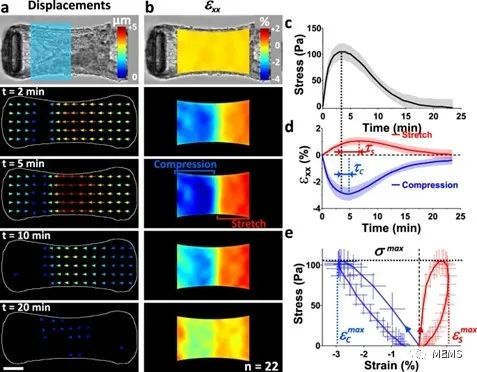
图3 光诱导的局部收缩证明了微组织的粘弹性
总之,组织工程和光遗传学的结合提供了独特的方法来定量证明物理和生物参数对3D组织中细胞引起的机械扰动的产生、传播和传感的影响。最重要的是,该方法为使用构成3D组织的细胞本身作为内部执行器实时和非破坏性地探测3D组织的流变性铺平了道路。总而言之,将细胞收缩性的光遗传学控制与专门设计的具有特定几何形状的微组织以及相应的计算模型结合,可以提供一种强大的方法来分析机械边界约束、细胞收缩性、细胞外基质密度、排列和机械特性之间复杂的相互作用。
然而,由于该方法通过利用组织中的一部分(受刺激的部分)的收缩来拉伸另一部分(未受刺激的部分)的方式来探测后者的机械特性,因此它本质上需要肌动球蛋白的活跃运转,这可能使对于细胞骨架成分在调节组织力学中的作用的研究复杂化。事实上,完全抑制微组织的收缩能力,例如使用高剂量的肌动球蛋白靶向药物,会阻碍该方法的使用。然而,只要收缩机制至少部分活跃,该方法就仍然有效,例如,只使用中小剂量的肌动球蛋白靶向药物。
此外,尽管CRY2富集到细胞膜的速度非常快(几秒钟),但它的解离速度较慢(几分钟),而RhoA通路的激活导致细胞先发生时长数十秒的收缩性激活,而后历经更为缓慢的时长几分钟的松弛。因此,细胞诱导性收缩和松弛需要将近20分钟,因此无法将其用于探测快速机械变化或量化微组织在不同频率下的时间依赖性机械响应。最后,该方法中的光遗传学靶标RhoA有许多下游效应器。虽然该研究使用单一的、短时间的刺激来诱导微组织的弹性反应,而不产生类似细胞骨架重塑等类型的持久影响,仍然不能排除可能存在通过例如RhoA的自我放大和自我抑制产生的脱靶效应。
审核编辑:刘清
-
效应器件
+关注
关注
0文章
2浏览量
5594 -
ECM
+关注
关注
3文章
57浏览量
28246 -
SPIV
+关注
关注
0文章
2浏览量
1697 -
测速仪
+关注
关注
0文章
22浏览量
4154
原文标题:光驱动生物执行器,可用于探测3D微组织流变性
文章出处:【微信号:MEMSensor,微信公众号:MEMS】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
TPS65735 用于主动快门 3D 眼镜的电源管理 IC数据手册
TechWiz LCD 3D应用:微液晶分子摩擦排布
3D IC背后的驱动因素有哪些?

高分子微纳米功能复合材料3D打印加工介绍

光学系统的3D可视化
安泰功率放大器在微纳光固化3D打印中的具体应用

音圈执行器:精密构造的科技杰作
电动执行器的标准输入信号范围是多少v
电动执行器常见故障及处理方法
气动执行器换电动执行器怎么换


TwinCAT3 EtherCAT抓包 | 技术集结
在使用TwinCAT测试EtherCATEOE功能时,我们会发现正常是无法使用Wireshark去进行网络抓包抓取EtherCAT报文的,今天这篇文章就带大家来上手EtherCAT抓包方式。准备环境硬件环境:EtherKit开发板网线一根Type-CUSB线一根软件环境TwinCAT3RT-ThreadstudiowiresharkEtherCATEOE工程

EtherCAT科普系列(8):EtherCAT技术在机器视觉领域的应用
机器视觉是基于软件与硬件的组合,通过光学装置和非接触式的传感器自动地接受一个真实物体的图像,并利用软件算法处理图像以获得所需信息或用于控制机器人运动的装置。机器视觉可以赋予机器人及自动化设备获取外界信息并认知处理的能力。机器视觉系统内包含光学成像系统,可以作为自动化设备的视觉器官实现信息的输入,并借助视觉控制器代替人脑实现信息的处理与输出。从而实现赋予自动化

新品 | 26+6TOPS强悍算力!飞凌嵌入式FCU3501嵌入式控制单元发布
飞凌嵌入式FCU3501嵌入式控制单元基于瑞芯微RK3588处理器开发设计,4xCortex-A76+4xCortex-A55架构,A76主频高达2.4GHz,A55核主频高达1.8GHz,支持8K编解码,NPU算力6TOPS,支持算力卡拓展,可以插装Hailo-8 26TOPS M.2算力卡。

接口核心板必选 | 视美泰AIoT-3568SC 、 AIoT-3576SC:小身材大能量,轻松应对多场景设备扩展需求!
在智能硬件领域,「适配」是绕不开的关键词。无论是小屏设备的”寸土寸金”,还是模具开发的巨额成本,亦或是多产品线兼容的复杂需求,开发者总在寻找一款能「以不变应万变」的核心解决方案。视美泰旗下的AIoT-3568SC与AIoT-3576SC接口核心板系列,可以说是专为高灵活适配场景而生!无需为设备尺寸、模具限制或产品线差异妥协,一块核心板,即可释放无限可能。为什

3核A7+单核M0多核异构,米尔全新低功耗RK3506核心板发布
近日,米尔电子发布MYC-YR3506核心板和开发板,基于国产新一代入门级工业处理器瑞芯微RK3506,这款芯片采用三核Cortex-A7+单核Cortex-M0多核异构设计,不仅拥有丰富的工业接口、低功耗设计,还具备低延时和高实时性的特点。核心板提供RK3506B/RK3506J、商业级/工业级、512MB/256MBLPDDR3L、8GBeMMC/256
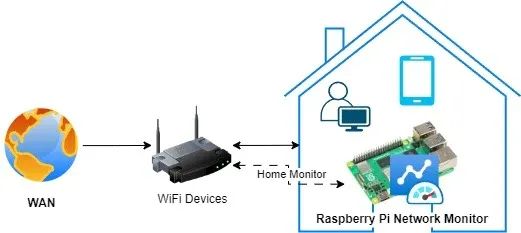
搭建树莓派网络监控系统:顶级工具与技术终极指南!
树莓派网络监控系统是一种经济高效且功能多样的解决方案,可用于监控网络性能、流量及整体运行状况。借助树莓派,我们可以搭建一个网络监控系统,实时洞察网络活动,从而帮助识别问题、优化性能并确保网络安全。安装树莓派网络监控系统有诸多益处。树莓派具备以太网接口,还内置了Wi-Fi功能,拥有足够的计算能力和内存,能够在Linux或Windows系统上运行。因此,那些为L
STM32驱动SD NAND(贴片式SD卡)全测试:GSR手环生物数据存储的擦写寿命与速度实测
在智能皮电手环及数据存储技术不断迭代的当下,主控 MCU STM32H750 与存储 SD NAND MKDV4GIL-AST 的强强联合,正引领行业进入全新发展阶段。二者凭借低功耗、高速读写与卓越稳定性的深度融合,以及高容量低成本的突出优势,成为大规模生产场景下极具竞争力的数据存储解决方案。

芯对话 | CBM16AD125Q这款ADC如何让我的性能翻倍?
综述在当今数字化时代,模数转换器(ADC)作为连接模拟世界与数字系统的关键桥梁,其技术发展对众多行业有着深远影响。从通信领域追求更高的数据传输速率与质量,到医疗影像领域渴望更精准的疾病诊断,再到工业控制领域需要适应复杂恶劣环境的稳定信号处理,ADC的性能提升成为推动这些行业进步的重要因素。行业现状分析在通信行业,5G乃至未来6G的发展,对基站信号处理提出了极
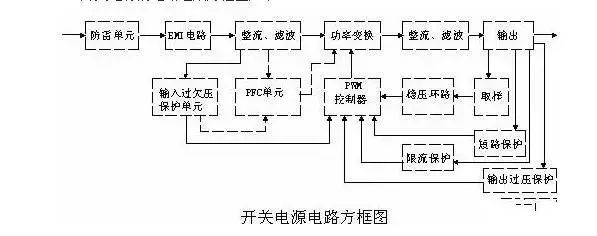
史上最全面解析:开关电源各功能电路
01开关电源的电路组成开关电源的主要电路是由输入电磁干扰滤波器(EMI)、整流滤波电路、功率变换电路、PWM控制器电路、输出整流滤波电路组成。辅助电路有输入过欠压保护电路、输出过欠压保护电路、输出过流保护电路、输出短路保护电路等。开关电源的电路组成方框图如下:02输入电路的原理及常见电路1AC输入整流滤波电路原理①防雷电路:当有雷击,产生高压经电网导入电源时
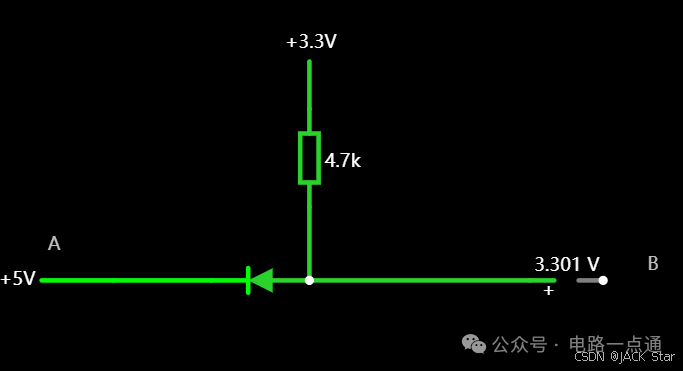
有几种电平转换电路,适用于不同的场景
一.起因一般在消费电路的元器件之间,不同的器件IO的电压是不同的,常规的有5V,3.3V,1.8V等。当器件的IO电压一样的时候,比如都是5V,都是3.3V,那么其之间可以直接通讯,比如拉中断,I2Cdata/clk脚双方直接通讯等。当器件的IO电压不一样的时候,就需要进行电平转换,不然无法实现高低电平的变化。二.电平转换电路常见的有几种电平转换电路,适用于

瑞萨RA8系列教程 | 基于 RASC 生成 Keil 工程
对于不习惯用 e2 studio 进行开发的同学,可以借助 RASC 生成 Keil 工程,然后在 Keil 环境下愉快的完成开发任务。

共赴之约 | 第二十七届中国北京国际科技产业博览会圆满落幕
作为第二十七届北京科博会的参展方,芯佰微有幸与800余家全球科技同仁共赴「科技引领创享未来」之约!文章来源:北京贸促5月11日下午,第二十七届中国北京国际科技产业博览会圆满落幕。本届北京科博会主题为“科技引领创享未来”,由北京市人民政府主办,北京市贸促会,北京市科委、中关村管委会,北京市经济和信息化局,北京市知识产权局和北辰集团共同承办。5万平方米的展览云集

道生物联与巍泰技术联合发布 RTK 无线定位系统:TurMass™ 技术与厘米级高精度定位的深度融合
道生物联与巍泰技术联合推出全新一代 RTK 无线定位系统——WTS-100(V3.0 RTK)。该系统以巍泰技术自主研发的 RTK(实时动态载波相位差分)高精度定位技术为核心,深度融合道生物联国产新兴窄带高并发 TurMass™ 无线通信技术,为室外大规模定位场景提供厘米级高精度、广覆盖、高并发、低功耗、低成本的一站式解决方案,助力行业智能化升级。

智能家居中的清凉“智”选,310V无刷吊扇驱动方案--其利天下
炎炎夏日,如何营造出清凉、舒适且节能的室内环境成为了大众关注的焦点。吊扇作为一种经典的家用电器,以其大风量、长寿命、低能耗等优势,依然是众多家庭的首选。而随着智能控制技术与无刷电机技术的不断进步,吊扇正朝着智能化、高效化、低噪化的方向发展。那么接下来小编将结合目前市面上的指标,详细为大家讲解其利天下有限公司推出的无刷吊扇驱动方案。▲其利天下无刷吊扇驱动方案一
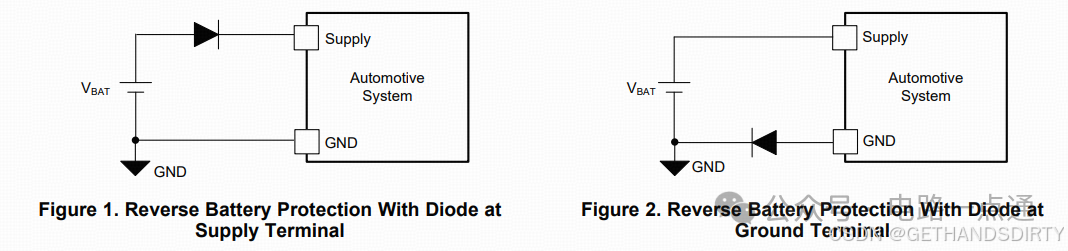
电源入口处防反接电路-汽车电子硬件电路设计
一、为什么要设计防反接电路电源入口处接线及线束制作一般人为操作,有正极和负极接反的可能性,可能会损坏电源和负载电路;汽车电子产品电性能测试标准ISO16750-2的4.7节包含了电压极性反接测试,汽车电子产品须通过该项测试。二、防反接电路设计1.基础版:二极管串联二极管是最简单的防反接电路,因为电源有电源路径(即正极)和返回路径(即负极,GND),那么用二极





 用于探测3D微组织流变性的光驱动生物执行器
用于探测3D微组织流变性的光驱动生物执行器













评论